Američka gnjiloća medonosne pčele (AGMP) – I dio
dr sc Zlatko Tomljanović
Ministarstvo poljoprivrede Republike Hrvatske
Američka gnjiloća medonosne pčele (AGMP) je opasna zarazna bolest poklopljenog i nepoklopljenog pčelinjeg legla koja predstavlja prijetnju suvremenoj pčelarskoj proizvodnji. Bolesna pčelinja zajednica slabi, smanjuje se broj odraslih pčela i površina zdravog legla te na kraju ugiba.
AGMP je utvrđena gotovo u svim regijama svijeta, na pet kontinenata, gdje postoje pčele i pčelarstvo. Međutim, bolest nije uobičajena u području južno od Sahare u Africi jer se smatra da afričke pasmine pčela pokazuju promjene u ponašanju u usporedbi s europskim pasminama pčela u smislu napuštanja legla i nastambe u slučaju uznemiravanja ili nestašice nektara i peluda pa tako znatan dio uzročnika AGMP ostaje u staroj napuštenoj košnici. Također, znanstveni izvori navode primitivan način pčelarenja u Africi primjenom tradicionalnih košnica u kojima ne postoji mogućnost premještanja okvira s leglom i/ili saćem između različitih pčelinjih zajednica, kao i učinak štetnika voskovog moljca koji istovremeno uništava medišno saće i uzročnika AGMP. Nadalje, navode higijensko ponašanje afričkih pasmina pčela u brzom otkrivanju i uklanjanju uginulih pčelinjih ličinki te smanjenu fiziološku primljivost ličinki afričkih pčela u odnosu na ličinke europskih pasmina pčela kao moguće čimbenike da AGMP nije raširena u sub-saharskoj Africi. Međutim, novija istraživanja su utvrdila prisutnost spora uzročnika AGMP u medu, prikupljenom od otkupljivača, u Južnoafričkoj Republici i Gvineji Bisau.

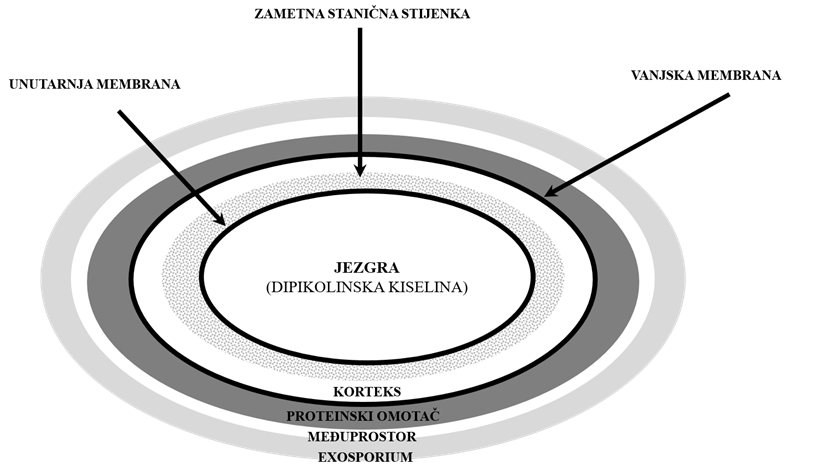
Uzročnik bolesti je Gram-pozitivna bakterija Paenibacillus larvae (P.larvae) koja u nepovoljnim uvjetima tvori ovalne spore koje su vrlo otporne pa u uginuloj i osušenoj ličinki, saću, pčelinjim proizvodima, pčelarskoj opremi i priboru, kao i okolišu ostaju infektivne desetljećima. Otpornost spora uvjetovana je njihovom strukturom i sastavnim dijelovima. Naime, spore P. larvae sadrže nekoliko slojeva koji se ne mogu pronaći u vegetativnim bakterijskim stanicama tijekom klijanja, uključujući vanjski sloj ili egzosporij, proteinski omotač te međuprostor između egzosporija i proteinskog omotača. Egzosporij je građen od proteina i ugljikohidrata, a smatra se da povećava adheziju spora na abiotičke površine olakšavajući njihov prijenos s onečišćenih na čiste površine. Proteinski omotač sadrži više od 50 genetski specifičnih proteina koji zaštićuju sporu od nametničkih protozoa i lizosomskih enzima, ali nema ulogu u otpornosti spora na toplinu, radijaciju i neke kemijske spojeve poput slobodnih radikala. Između proteinskog omotača i sloja peptidoglikana koji čine koru ili korteks spore, nalazi se vanjska membrana koja ima bitnu ulogu u formiranju novih spora, ali još nije razjašnjena njena ulogu u otpornosti spora. Postoje podijeljena mišljenja oko uloge vanjske membrane u svezi otpornosti. Dio istraživača je smatrao da vanjska membrana ima ulogu propusne barijere dok se drugi nisu slagali, a treći smatraju da je vanjska membrana rudimentarna struktura spore bez očite funkcije. Ispod vanjske membrane nalazi se korteks, a ispod zametna stanična stijenka i unutarnja membrana. Većina glavnih proteina, uključenih u klijanje spora, nalazi se u unutrašnjoj membrani ili tijesno priliježu na nju. Fosfolipidna struktura unutarnje membrane odlikuje se naglašenim viskozitetom i niskom propusnošću za male hidrofilne spojeve, uključujući i vodu, u usporedbi s rastućim bakterijskim stanicama tijekom klijanja. Nizak sadržaj vode u jezgri spora vjerojatno je glavni razlog minimalne metaboličke aktivnosti spora i nepokretljivosti proteina u jezgri, iako dio znanstvenika smatra da je većina vode u jezgri spore pokretna.
Poznato je da vegetativni štapići bakterije P. larvae posjeduju duge, peritriho raspoređene cilije koje omogućuju aktivno kretanje. Logična pretpostavka je stoga bila da bi se bakterija P. larvae mogla koordinirano i aktivno kretati u obliku roja (swarming motility) te tvoriti biofilm. Danas se kretanje u obliku roja smatra najbrže poznatim bakterijskim načinom površinske translokacije koje omogućuje brzu kolonizaciju okoliša i nosioca bogatih hranjivim tvarima. Biofilmove možemo definirati kao visoko strukturirane, kompleksne zajednice bakterija povezane izvanstaničnim matriksom koji same izlučuju. Iznimna važnost biofilma za bakterijski život ogleda se u spoznaji da oni štite bakterije od imunološkog sustava nosioca i različitih dezinfekcijskih postupaka. Tvorba biofilma počinje mikrobnom adhezijom te naknadnom proizvodnjom i nakupljanjem izvanstaničnog matriksa koji je sastavljen od bjelančevina, polisaharida, huminskih tvari, biosurfaktanta, izvanstanične DNK, a ponekad i drugih molekula uključenih u međustaničnu komunikaciju. Biofilmovi se mogu pojaviti kao sesilne zajednice na biotičkim ili abiotičkim površinama ili mogu plutati na granici između zraka i vode. Međutim, bakterije mogu tvoriti i slobodno plutajuće biofilmove, a FÜNFHAUS i suradnici (2018.) utvrdili su da se bakterija P. larvae genotipa ERIC II može površinski kretati u obliku roja te da tvori slobodno plutajući biofilm dok P. larvae genotipa ERIC I može tvoriti biofilm, ali se ne može kretati u obliku roja. Također, predložili su mogućnost da je ne-ribosomski peptid (NRP) penilarvin, kao biosurfaktant, vjerojatno ključan za kretanje bakterija u obliku roja kod genotipa ERIC II. Spoznaja da je bakterija P. larvae sposobna proizvoditi biofilm te se aktivno kretati u obliku roja uvjetovala je potrebu za novim pristupima u dezinfekcijskim postupcima pri prevenciji, te nakon sanacije klinički vidljive AGMP na pčelinjacima .
Infektivni oblik P. larvae su spore, a prijemljive za infekciju su pčelinje ličinke u dobi kad uzimaju hranu. Za infekciju jedne pčelinje ličinke mlađe od jednog dana potrebno je samo deset spora, ali starenjem primljivost se smanjuje te je potrebno više od deset milijuna spora za infekciju ličinke stare između četiri i pet dana. Štoviše, broj spora potreban za uzrokovanje infekcije u kasnijim fazama razvoja pčelinjih ličinki je toliko visok da infekcija prirodnim putem nije moguća. Treba naglasiti da jedna uginula ličinka može sadržavati do 2,5 milijardi novostvorenih spora.
Primjenom složenih molekularnih metoda utvrđeno je pet genotipa P. larvae: ERIC I, ERIC II, ERIC III i ERIC IV te ERIC V u uzorku meda iz Španjolske. Nedavno utvrđivanje novog genotipa ERIC V sugerira moguće postojanje još neotkrivenih genotipova. Tijekom posljednjih desetljeća ERIC I i ERIC II su najčešće izolirani genotipovi bakterije P. larvae iz meda ili pčelinjih zajednica oboljelih od AGMP, dok genotipovi ERIC III i ERIC IV imaju slabiju prevalencu i nisu izolirani posljednjih godina u terenskim uvjetima već su zastupljeni u povijesnim izolatima. Takva rasprostranjenost genotipova je u skladu sa znanstvenim istraživanjem BEIMS i suradnika (2020.) koji su utvrdili da je 66,7 % izolata P. larvae pripadalo ERIC I, a 29,6 % izolata genotipu ERIC II.
Fenotipske razlike između pojedinih genotipova uključuju razlike u morfologiji, metaboličkom kapacitetu, virulenciji te čimbenicima koji utječu na virulenciju. Virulencija bakterije P. larvae uvjetovana je mogućnošću inficiranja pčelinje ličinke kao nosioca i vremenom potrebnim do uginuća inficirane ličinke. Stvaranje velike količine dugoživućih i otpornih spora te mogućnost umnažanja i razvoja vegetativnih oblika bakterije omogućuje visoku vjerojatnost infekcije s navedenim uzročnikom bolesti. Analizom patogenosti, odnosno virulencije, uočene su značajne razlike između genotipova bakterije P. larvae ERIC I do ERIC IV te između genotipova ERIC I do ERIC V. ERIC I genotipu bakterije P. larvae potrebno je 12 dana da prouzroči ugibanje svih zaraženih ličinki (LT100 = 12 dana), a genotipovima ERIC II do ERIC IV sedam dana. Navedeni rezultati podudaraju se s nedavnim istraživanjima LT100 kod genotipova ERIC I i ERIC II, ali oni nisu u skladu jer LT100 za genotipove ERIC III i ERIC IV iznosi tri dana. Stoga su, s obzirom na brzinu ugibanja pčelinjih ličinki, genotipovi ERIC I do ERIC V svrstani u tri grupe: ERIC I koji sporo dovodi do ugibanja zaražene pčelinje ličinke, ERIC II koji umjereno brzo dovodi do ugibanja zaražene ličinke te ERIC III do ERIC V koji su genotipovi uzročnika koji brzo dovode do ugibanja zaražene ličinke.
Rezultati ispitivanja LT100 za ERIC II ukazuju da će sve zaražene pčelinje ličinke uginuti prije poklapanja stanica saća voštanim poklopcima. Na taj način kućne pčele čistačice imaju dovoljno dugo vremena za uklanjanje uginulih zaraženih pčelinjih ličinki. Pri tome dolazi do narušavanja procesa stvaranja spora na razini pčelinje zajednice što doprinosi usporavanju širenja i razvoja bolesti. Međutim, genotip ERIC I je slabije virulentan na razini pojedinačne ličinke jer zaražene ličinke ugibaju nakon poklapanja stanica saća. Smatra se da se genotip ERIC I bakterije P. larvae evolucijski prilagodio kako bi izbjegao higijensko ponašanje pčela čistačica. Posljedično se smanjuje uklanjanje uginulih ličinki u takvim slučajevima, a mogućnost proizvodnje i širenja infektivnih spora uzročnika je znatno povećana . U konačnici, genotip ERIC I je visoko virulentan za pčelinju zajednicu što dovodi do njenog brzog propadanja u usporedbi s ERIC II koji pokazuje nižu virulenciju na razini pčelinje zajednice i time uzrokuje njeno sporije propadanje. Ovo je u skladu s predloženom negativnom korelacijom virulencije bakterije P. larvae na razini ličinke i razini pčelinje zajednice te epizootiološke prevalencije genotipa ERIC I u terenskim uvjetima.
FÜNFHAUS i suradnici (2018.) utvrdili su da se patogeneza AGMP može podijeliti na patogenu fazu koja traje do trenutka uginuća pčelinje ličinke, te saprofitnu fazu u kojoj se odvija razgradnja uginule pčelinje ličinke. Obje faze su podjednako važne za životni ciklus bakterije P. larvae pri čemu uginuće pčelinje ličinke ne predstavlja kraj vegetativnog razvoja već samo razdoblje prijelaza od patogene prema saprofitnoj fazi.
Ubrzo nakon uzimanja hrane onečišćene sporama bakterije P. larvae, one klijaju u srednjem crijevu pčelinje ličinke. Pri tome dolazi do proliferacije vegetativnih oblika bakterije P. larvae bez oštećivanja epitela srednjeg crijeva. Proliferacija traje danima, pa je vjerojatni izvor hranjivih tvari za bakteriju P. larvae, hrana bogata ugljikohidratima koju zaražene pčelinje ličinke još uvijek dobivaju od odraslih pčela hraniteljica, a vegetativni oblici P. larvae ju mogu metabolizirati.
U slijedećoj fazi vegetativni oblici oštećuju peritrofnu membranu i epitelne stanice srednjeg crijeva inficirane pčelinje ličinke te konačno ulaze u hemocel i uzrokuju njeno ugibanje. Peritrofna membrana se sastoji od proteina, glikoproteina i hitinskih vlakana građenih od netopljivog linearnog beta-1,4-vezanog N-acetilglukozamina i njezina razgradnja je značajan čimbenik patogeneze bolesti. Utvrđeno je da svi genotipovi bakterije P. larvae, ERIC I do ERIC V posjeduju hitin degradirajući enzim PlCBP49 putem kojeg bakterija P. larvae razgrađuje peritrofnu membranu. Na svom putu iz srednjeg crijeva u hemocel bakterija P. larvae genotipa ERIC I koristi izvanstanične puteve i oštećuje međustanične strukture epitelnih visokoprizmatičnih stanica srednjeg crijeva i peritrofne membrane.
Na osnovu rezultata istraživanja provedenih molekularnim metodama DJUKIC i suradnici (2014.) predložili su postojanje različitih strategija prodiranja bakterije P. larvae u hemocel pčelinje ličinke za genotipove ERIC I i ERIC II. Naime, nakon razgradnje peritrofne membrane, genotip bakterije P. larvae ERIC I proizvodi toksine Plx 1 i Plx 2 koji oštećuju tkivo između epitelnih stanica srednjeg crijeva inficirane ličinke. Prisutnost toksina Plx 1 i Plx 2 kod genotipa bakterije P. larvae ERIC I smatra se specifičnim čimbenikom za njegovu virulenciju. Kod genotipa bakterije P. larvae ERIC II nije utvrđena proizvodnja ni izlučivanje toksina Plx1, ali je prisutan toksin Plx2. Također, kod svih genotipova bakterije P. larvae ERIC I do ERIC V utvrđen je C3 larvin toxin, ali njegova pato-biološka uloga zasad nije razjašnjena. Novijim istraživanjima utvrđena je neučinkovitost C3 larvin toxin-a u patogenezi AGMP.
Međutim, genotip bakterije P. larvae ERIC II može kodirati gene za proizvodnju proteina površinskog sloja SplA. Proteini površinskog sloja su netopivi glikoproteini i prekrivaju površinu mnogih patogenih bakterija. Oni mogu činiti do 20 % ukupne mase bakterijskih proteina i važan su čimbenik bakterijske komunikacije s okolinom. Pomažu bakteriji u izbjegavanju odgovora imunološkog sustava nosioca. Također, posreduju u vezanju patogene bakterije na epitelne stanice srednjeg crijeva ličinke i smatraju se specifičnim čimbenicima za virulenciju genotipa bakterije P. larvae ERIC II. Međutim, još uvijek nije potpuno razjašnjeno što se događa nakon vezanja SplA na površinu epitelnih stanica srednjeg crijeva inficiranih ličinka, kao niti način ulaska u hemocel pčelinje ličinke. Sinteza proteina površinskog sloja moguća je i kod genotipa bakterije P. larvae ERIC V, ali izostaje kod genotipova ERIC I i ERIC III do ERIC IV. To dovodi do zaključka da prisutnost gena za sintezu SplA nije odlučujuća za brzo ugibanje inficiranih pčelinjih ličinki, budući da ti geni nedostaju kod genotipova bakterije P. larvae ERIC III do ERIC IV.
Također, utvrđeno je da određeni ERIC genotipovi bakterije P. larvae sadrže gene za sintezu ribosomskih peptida, ali i velike skupine gena sposobne za kodiranje enzimatskih skupina i proizvodnju NRP i poliketida (PK) poput penilarvina, penilamicina, bacilibactina i sevadicina kod napada na epitelne stanice srednjeg crijeva inficirane ličinke. Pri tome se smatralo da NRP i PK pokazuju antibiotsko djelovanje. Tako je za genotipove bakterije P. larvae ERIC I i ERIC II utvrđeno da proizvode NRP i PK hibrid penilamicin dok ERIC II-III proizvode penilarvin A i C te sevadicin koji pokazuje antibakterijsko djelovanje. Iako penilarvin pokazuje i protugljivičnu aktivnost, ne može se sa sigurnošću potvrditi citotoksičnost penilarvina i bacilibactina, kao ni njihova uloga u virulentnosti bakterije P. larvae . Međutim, smatra se da penilarvin ima ključnu ulogu kao biosurfaktant kod površinskog gibanju bakterija u obliku roja te je bitan za uklanjanje crijevne mikrobiote u saprofitskoj fazi. Također, utvrđeno je da genotipovi ERIC I do ERIC IV vjerojatno sintetiziraju siderofor bacilibactin u uvjetima nedostatka željeza tijekom saprofitne faze. Nedavno provedena istraživanja potvrđuju da genotip bakterije P. larvae ERIC V može također sintetizirati bacilbactin. Snažnu antibakterijsku i protugljivičnu aktivnost pokazuje penilamicin koji se smatra odgovornim za uklanjanje mikrobiote iz srednjeg crijeva pčelinje ličinke u ranoj fazi te saprofitskih bakterija poput P. alvei u kasnoj fazi raspadanja uginule pčelinje ličinke. To je u skladu s ranije objavljenim radovima u kojima je potvrđeno da bakterija P. larvae može uspješno ukloniti konkurentnu mikrofloru jer u uginulim i osušenim pčelinjim ličinkama nalazimo samo spore bakterije P. larvae . Time je pretpostavka da bakterija P. larvae ima antimikrobna svojstva potvrđena.
Nakon ulaza u hemocel, vegetativni oblik bakterije P. larvae nastavlja s razgradnjom tkiva uginule ličinke i pretvara je u bezobličnu, smeđu i viskoznu masu. U tom stupnju infekcije bakterija P. larvae koristi izvanstanični sadržaj i stanične sastavnice tkiva propale ličinke kao izvor hranjivih tvari. Pri nastanku nepovoljnih životnih uvjeta slijedi sporulacija vegetativnih oblika bakterije u spore. Nedavni izvori sugeriraju da se sporulacija događa tijekom ukupnog trajanja infekcije, a ne samo u tkivu propale ličinke, već započinje odmah po uspješnoj kolonizaciji crijeva inficirane pčelinje ličinke. Osušena propala pčelinja ličinka sadrži milijarde novostvorenih infektivnih spora koje su spremne u povoljnim uvjetima proklijati i uzrokovati infekciju.
povezane novosti:
Foto: MALIŠANIMA ODRŽANA EDUKATIVNA RADIONICA O PČELARSTVU
Danas je, u vrtiću "Dvor", održan slovenački doručak a tokom kojeg je mališanima predškolskog uzrasta održana edukativna radionica o pčelarstvu. Edukativno predavanje održ
Samo za vrijedne pčelare | Pčelarski radovi tokom narednog perioda
Vrlo je važno oboriti što više varoe kako bi u proljeće društva ušla čista.